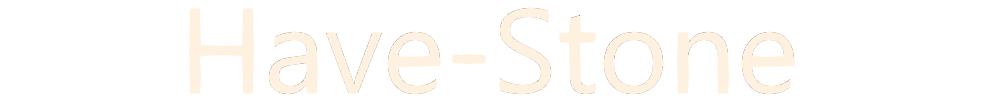蒸気圧と沸騰を正しく理解する
まず、教科書や参考書の「蒸気圧」と「沸騰」の説明図を見てください。
違いが分かりますか。
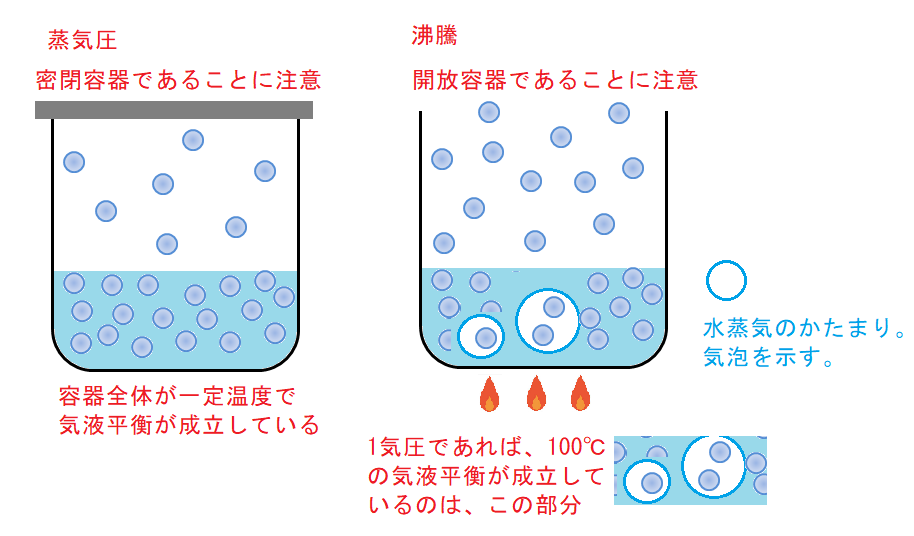
「蒸気圧」の説明図は、容器に「ふた」があります。つまり、「密閉容器」です。
「沸騰」の説明図には「ふた」はありません。このような状態を「開放」と言います。
次に、「蒸気圧」の説明図に、ちゃんと書いてあるかどうか疑問ですが(教科書には正しく書いてあるはずです。)
「温度一定」となっているはずです。
「蒸気圧」の説明は、「密閉容器で、全体が一定温度」であることを忘れてはいけません。
「気液平衡」とは「蒸発の速度=凝縮の速度」なので、容器全体が一定温度でなければ、そもそも成り立ちません。
それに対して、「沸騰」の説明は、仮に100℃だとした場合100℃になっている場所は、「液体の内部」だけです。液体表面から少しでも離れれば、そこは100℃より低い温度です。
なので、この説明図では、液体内部以外では「気液平衡」を考える前提になっていません。そもそも「ふた」がないのですから、戻ってくる蒸気はほぼありません。だからこそ、沸騰している水(お湯は)とどんどん減ります。
では、100℃における「気液平衡」はどこなのか。当然、液体内部の「100℃のお湯とブクブクしている気体の塊(気泡)の間で成り立つのです。教科書等の説明では、その部分の拡大図が書いてあるはずです。
気泡は大気圧と同じ圧力の蒸気圧なのでつぶれないのです。
100℃以下では「沸騰」しないのは、気泡ができたとしても「大気圧」より「蒸気圧」が小さいので、つぶされるからです。
最後に付け加えるとしたら、頑丈な「密閉容器」であれば、外圧の影響を受けないので、温度を高くしても「沸騰」は起きません。